Кристаллизация мембранных белковСтраница 1
Наиболее детальную структурную информацию об очищенных мембранных белках можно получить, исследуя методом рентгеновской дифракции трехмерные белковые кристаллы. К сожалению, оказалось, что интегральные мембранные белки очень трудно кристаллизовать. Будучи удалены из своего естественного липидного окружения, неполярные участки липидных молекул склонны агрегировать с образованием неупорядоченных форм, непригодных для кристаллографического анализа. Ясно, что необходимы специальные методы, позволяющие обойти эти трудности, и в этом был достигнут определенный прогресс. Михель обратил внимание, что мембранные белки образуют кристаллы двух типов. Кристаллы типа I напоминают стопки мембран. В них осуществляется латеральное взаимодействие между неполярными участками, а мембраноподобные слои связывают полярные участки белков. Подобные кристаллы были получены для нескольких белков, но ни в одном случае их нельзя было исследовать с помощью дифракции с высоким разрешением. Кристаллы типа II стабилизируются за счет контактирования полярных участков белковых молекул, а небольшие амфифильные соединения или детергенты в основном заполняют промежутки между ними. Заметим, что очень важными являются размер, заряд и другие свойства детергентов; если эти параметры неблагоприятны, то детергент может дестабилизировать кристаллическую структуру.
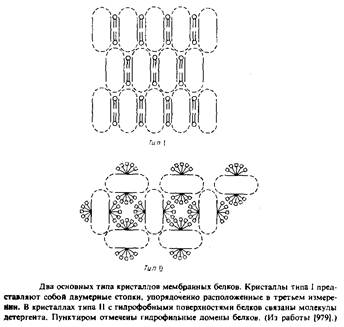
Кристаллы типа II образуют белки фотосинтетического реакционного центра Rhodopseudomonas viridis. Имеются данные, что близка к завершению работа по установлению структуры матриксного порина с высоким разрешением из наружной мембраны Е. coli.
Итак, мембранные белки можно кристаллизовать, и хотя число Успешных попыток пока невелико, можно сделать несколько выводов, касающихся методологии кристаллизации.
1. Белки кристаллизуются вместе с детергентом.
2. Очень важен выбор детергента. По-видимому, наиболее при- годны цвиттерионные или неионные детергенты с высокой ККМ и Малым размером мицелл.
Таблица 1. Мембранные белки, которые были закристаллизованы
|
Белок |
Ссылки | |
|
1. |
Реакционный центр R. viridis " | |
|
2. |
Реакционный центр R. sphaeroides " | |
|
3. |
Реакционный центр фотосистемы 1 | |
|
циаиобактерий Phormidium laminosum | ||
|
4. |
OmpF | |
|
5. |
OmpA | |
|
" | ||
|
6. |
LamB | |
|
7. |
Бактериородопсин |
Другие статьи:
Паразитизм
В отличие от хищничества паразитизм характеризуется следующими основными особенностями:
1) паразит в течение всей своей жизни нападает всего на одну особь (редко – на многих) и поедает только часть своей жертвы (хозяина); паразит причиня ...
Экология
Многие полиноиды обитают в прибрежной зоне Баренцева моря, и крепко прикрепляются к камням; некоторые соответствуют планктонному образу жизни (Bylgides Sarsi). Полиноиды (Psammolyce) зарываются в песок и ползают по поверхности грунта, кру ...
Биология косули
Систематическое положение.
Подотряд Жвачные Ruminantia
Семейство Олени Cervidae
Подсемейство Американские олени Odocoileinae
Внешний вид.
Внешне косуля похожа на небольшого оленя. Размер тела колеблется в зависимости от условий обита ...
