Молекулярные основы эволюции (белки, нуклеиновые
кислоты, первичный и вторичный генетический коды)Страница 1
Белки, высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью – СО–NH– Каждый белок. характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белков приходится не менее 50% сухой массы орг. соединений животной клетки. Функционирование белков лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белков и нуклеиновых кислот
По составу белки делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла или пигмент. В соответствии с формой молекул белки подразделяют на глобулярные и фибриллярные. Молекулы первых свернуты в компактные глобулы сферической или эллипсоидной формы, молекулы вторых образуют длинные волокна (фибриллы) и высокоасимметричны. Большинство глобулярных белков, в отличие от фибриллярных, растворимы в воде.
Строение белковых молекул.
Практически все белки построены из 20![]() аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и
аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и![]() аминогруппами соседних аминокислотных остатков (см. формулу I):
аминогруппами соседних аминокислотных остатков (см. формулу I):
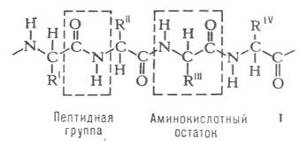 (формула I)
(формула I)
Белковая молекула может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда – более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков, часто относят к пептидам.
Различают четыре уровня организации белковых молекул. Последовательность аминокислотных остатков в полипептидной цепи наз. первичной структурой. Все белки различаются по первичной структуре; потенциально возможное их число практически неограниченно. Термин «вторичная структура» относится к типу укладки полипептидных цепей. Наиболее часто встречающиеся типы – правая![]() спираль и
спираль и![]() структура. Под третичной структурой белков понимают расположение его полипептидной цепи в пространстве. Термин «четвертичная структура» относится к макромолекулам, в состав которых входит несколько полипептидных цепей, не связанных между собой ковалентно. Такая структура отражает способ объединения и расположения этих субъединиц в пространстве.
структура. Под третичной структурой белков понимают расположение его полипептидной цепи в пространстве. Термин «четвертичная структура» относится к макромолекулам, в состав которых входит несколько полипептидных цепей, не связанных между собой ковалентно. Такая структура отражает способ объединения и расположения этих субъединиц в пространстве.
Свойства.
Физ.-хим. свойства белков определяются их высокомолекулярной природой, компактностью укладки полипептидных цепей и взаимным расположением остатков аминокислот
Синтез.
Биосинтез белков происходит в результате трансляции в субклеточных частицах – рибосомах, представляющих собой сложный рибонуклеопротеидный комплекс. Информация о первичной структуре белка «хранится» в соответствующих генах – участках ДНК – в виде последовательности нуклеотидов. В процессе транскрипции эта информация с помощью фермента – ДНК – зависимой РНК – полимеразы – передается на матричную рибонуклеиновую кислоту, которая, соединяясь с рибосомой, служит матрицей для синтеза белка. Выходящие из рибосомы синтезированные полипептидные цепи, самопроизвольно сворачиваясь, принимают присущую данному белку конформацию, а также подвергаются модификации благодаря реакциям различных функциональных групп аминокислотных остатков и расщеплению пептидных связей.
Значение белков в питании.
Белки – необходимая составная часть продуктов питания. В процессе пищеварения Б. подвергаются гидролизу до аминокислот, которые и всасываются в кровь. Пищевая ценность белков зависит от их аминокислотного состава, содержания в них, так называемых, незаменимых аминокислот, не синтезирующихся в организмах. В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот. Перспективно использование для этого методов генетической инженерии.
Нуклеиновые кислоты (полинуклеотиды), биополимеры, осуществляющие хранение и передачу генетической информации во всех живых организмах, а также участвующие в биосинтезе белков.
Другие статьи:
Метод люминолзависимой хемилюминесценции в цельной крови
Хемилюминесценцию измеряли на аппарате ХЛМ-003 в соответствии с инструкцией к прибору и методическими рекомендациями авторов разработки [10, 23, 59, 60].
Перед исследованием отбирали необходимое количество рабочего раствора люминола из р ...
Экологические группы жужелиц по степени увлажнения предпочитаемых биотопов
Дефицит влаги – одна из наиболее существенных особенностей наземно-воздушной среды жизни. Протекание всех биохимических процессов в клетках и в организме в целом возможны только при достаточном обеспечении его водой. Вся эволюция наземных ...
Eotaxin
СПИСОК СОКРАЩЕНИЙ
БПС (STP)
– белки-переносчики сигнала
ГВЗ– гнойно-воспалительные заболевания
Г-КСФ
– гранулоцитарный колониестимулирующий фактор
ГМ-КСФ
– гранулоцитарно-макрофагальный колониестимулирующий фактор
ГКГ– главный ...
